Elementos Químicos e Átomos: O que são, definição

Você provavelmente está familiarizado com o conceito de átomos. Eles são a unidade fundamental da matéria – tudo é composto de átomos, que se unem de maneiras únicas para formar coisas diferentes. Antes que você possa entender as reações químicas, você deve primeiro entender o modo como os átomos funcionam.
Ao longo dos anos, os cientistas usaram modelos diferentes para visualizar átomos à medida que nosso entendimento mudou. Você pode estar familiarizado com alguns dos modelos da Figura 1. Neste curso, nós usamos amplamente o modelo de Bohr.

Figura 1. A evolução dos modelos atômicos ao longo dos anos. À medida que nossa compreensão dos átomos evoluiu, os modelos que usamos para representá-los mudaram. O primeiro modelo é o modelo de Thomson, seguido pelo modelo de Rutherford, o modelo de Bohr e o modelo de Heisenberg / Schrödinger.
Elementos na matéria biológica
Em seu nível mais fundamental, a vida é composta de matéria. Matéria é qualquer substância que ocupa espaço e tem massa. Elementos são formas únicas de matéria com propriedades químicas e físicas específicas que não podem ser decompostas em substâncias menores por reações químicas comuns. Existem 118 elementos, mas apenas 92 ocorrem naturalmente. Os elementos restantes são sintetizados em laboratórios e são instáveis.
Cada elemento é designado por seu símbolo químico, que é uma letra maiúscula única ou, quando a primeira letra já é “tirada” por outro elemento, uma combinação de duas letras. Alguns elementos seguem o termo em inglês para o elemento, como C para carbono e Ca para cálcio. Os símbolos químicos de outros elementos derivam de seus nomes latinos; por exemplo, o símbolo do sódio é Na, referindo-se ao natrium , a palavra latina para sódio.
Os quatro elementos comuns a todos os organismos vivos são oxigênio (O), carbono (C), hidrogênio (H) e nitrogênio (N). No mundo não vivo, os elementos são encontrados em diferentes proporções, e alguns elementos comuns aos organismos vivos são relativamente raros na Terra como um todo, como mostra a Tabela 1. Por exemplo, a atmosfera é rica em nitrogênio e oxigênio, mas contém pouco carbono e hidrogênio, enquanto a crosta terrestre, embora contenha oxigênio e uma pequena quantidade de hidrogênio, tem pouco nitrogênio e carbono. Apesar de suas diferenças em abundância, todos os elementos e as reações químicas entre eles obedecem às mesmas leis químicas e físicas, independentemente de serem ou não parte do mundo vivo ou não vivo.
| Tabela 1. Porcentagem Aproximada de Elementos em Organismos Vivos (Humanos) Comparados ao Mundo Não Vivo | |||
|---|---|---|---|
| Elemento | Vida (humanos) | Atmosfera | Crosta da terrra |
| Oxigênio (O) | 65% | 21% | 46% |
| Carbono (C) | 18% | vestígio | vestígio |
| Hidrogênio (H) | 10% | vestígio | 0,1% |
| Nitrogênio (N) | 3% | 78% | vestígio |
Átomos
Para entender como os elementos se juntam, devemos primeiro discutir o menor componente ou bloco de construção de um elemento, o átomo. Um átomo é a menor unidade de matéria que retém todas as propriedades químicas de um elemento. Por exemplo, um átomo de ouro tem todas as propriedades do ouro, pois é um metal sólido à temperatura ambiente. Uma moeda de ouro é simplesmente um número muito grande de átomos de ouro moldados na forma de uma moeda e contendo pequenas quantidades de outros elementos conhecidos como impurezas. Os átomos de ouro não podem ser decompostos em nada menor, mantendo as propriedades do ouro.

Figura 2. Elementos como o hélio, aqui representados, são compostos de átomos. Os átomos são compostos de prótons e nêutrons localizados dentro do núcleo, com elétrons em orbitais ao redor do núcleo.
Todos os átomos contêm prótons, elétrons e nêutrons (Figura 2). A única exceção é o hidrogênio (H), que é feito de um próton e um elétron.
Um próton é uma partícula carregada positivamente que reside no núcleo(o núcleo do átomo) de um átomo e tem uma massa de 1 e uma carga de +1.
Os nêutrons , como os prótons, residem no núcleo de um átomo. Eles têm uma massa de 1 e sem custo. As cargas positivas (prótons) e negativas (elétrons) se equilibram em um átomo neutro, que tem uma carga líquida nula.
Um elétron é uma partícula carregada negativamente que viaja no espaço ao redor do núcleo. Em outras palavras, ele reside fora do núcleo. Tem uma massa desprezível e tem uma carga de –1.
Como cada um dos prótons e nêutrons tem uma massa de 1, a massa de um átomo é igual ao número de prótons e nêutrons desse átomo. O número de elétrons não leva em consideração a massa total, porque sua massa é muito pequena.
CONSTRUA UM ÁTOMO
Construa um átomo a partir de prótons, nêutrons e elétrons e veja como o elemento, a carga e a massa mudam. Então jogue um jogo para testar suas idéias!
Propriedades dos Elementos
Número Atômico e Massa
Cada elemento tem suas próprias propriedades exclusivas. Cada um contém um número diferente de prótons e nêutrons, dando a ele seu próprio número atômico e número de massa. O número atômico de um elemento é igual ao número de prótons que o elemento contém. O número de massa é o número de prótons mais o número de nêutrons desse elemento. Portanto, é possível determinar o número de nêutrons subtraindo o número atômico do número de massa.
Esses números fornecem informações sobre os elementos e como eles reagirão quando combinados. Diferentes elementos têm diferentes pontos de fusão e ebulição, e estão em diferentes estados (líquido, sólido ou gás) à temperatura ambiente. Eles também se combinam de maneiras diferentes. Alguns formam tipos específicos de títulos, enquanto outros não. Como eles se combinam é baseado no número de elétrons presentes. Por causa dessas características, os elementos são organizados na tabela periódica dos elementos, um gráfico dos elementos que inclui o número atômico e a massa atômica relativa de cada elemento. A tabela periódica também fornece informações importantes sobre as propriedades dos elementos (Figura 3) – geralmente indicadas por códigos de cores. O arranjo da tabela também mostra como os elétrons em cada elemento são organizados e fornece detalhes importantes sobre como os átomos reagirão uns com os outros para formar moléculas.
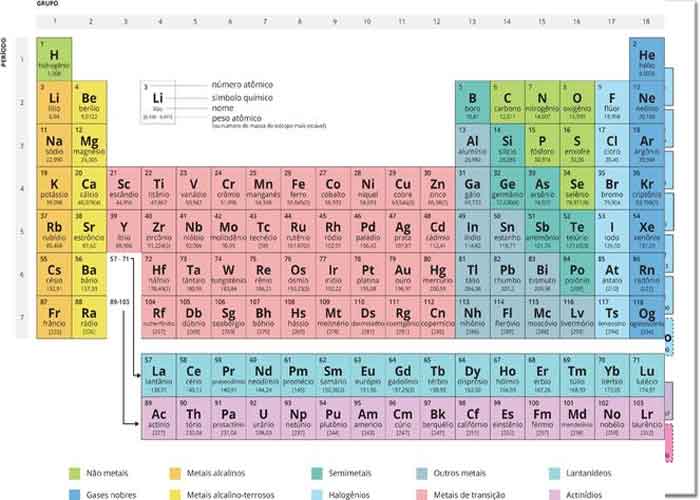
Figura 3. Organizada em colunas e linhas com base nas características dos elementos, a tabela periódica fornece informações importantes sobre os elementos e como eles podem interagir uns com os outros para formar moléculas. A maioria das tabelas periódicas fornece uma chave ou legenda às informações que elas contêm.
Interações de Elemento
Como os elementos interagem uns com os outros depende de como seus elétrons estão dispostos e quantas aberturas de elétrons existem na região mais externa, onde os elétrons estão presentes em um átomo. Elétrons existem em níveis de energia que formam conchas ao redor do núcleo. A casca mais próxima pode conter até dois elétrons. A concha mais próxima do núcleo é sempre preenchida primeiro, antes que qualquer outra casca possa ser preenchida. O hidrogênio tem um elétron; portanto, ele tem apenas um ponto ocupado na casca mais baixa. O hélio tem dois elétrons; portanto, ele pode preencher completamente a camada mais baixa com seus dois elétrons. Se você olhar para a tabela periódica, verá que o hidrogênio e o hélio são os únicos dois elementos da primeira linha. Isso é porque eles só têm elétrons em sua primeira casca.
O segundo e terceiro níveis de energia podem conter até oito elétrons. Os oito elétrons estão dispostos em quatro pares e uma posição em cada par é preenchida com um elétron antes que os pares sejam completados.
Olhando a tabela periódica novamente (Figura 3), você notará que existem sete linhas. Essas linhas correspondem ao número de shells que os elementos dentro dessa linha possuem. Os elementos dentro de uma linha particular têm um número crescente de elétrons conforme as colunas procedem da esquerda para a direita. Embora cada elemento tenha o mesmo número de conchas, nem todas as conchas estão completamente preenchidas com elétrons. Se você observar a segunda linha da tabela periódica, encontrará lítio (Li), berílio (Be), boro (B), carbono (C), nitrogênio (N), oxigênio (O), flúor (F), e neon (Ne). Todos eles têm elétrons que ocupam apenas a primeira e a segunda concha. O lítio tem apenas um elétron em sua camada mais externa, o berílio tem dois elétrons, o boro tem três, e assim por diante, até que todo o invólucro esteja cheio de oito elétrons, como é o caso do neon.
Isótopos
Os isótopos são formas diferentes do mesmo elemento que possuem o mesmo número de prótons, mas um número diferente de nêutrons. Alguns elementos, como carbono, potássio e urânio, possuem isótopos naturais. O carbono-12, o isótopo mais comum do carbono, contém seis prótons e seis nêutrons. Portanto, tem um número de massa de 12 (seis prótons e seis nêutrons) e um número atômico de 6 (o que o torna carbono). Carbono 14 contém seis prótons e oito nêutrons. Portanto, tem um número de massa de 14 (seis prótons e oito nêutrons) e um número atômico de 6, o que significa que ainda é o elemento carbono. Essas duas formas alternativas de carbono são isótopos. Alguns isótopos são instáveis e perdem prótons, outras partículas subatômicas ou energia para formar elementos mais estáveis. Estes são chamados isótopos radioativosou radioisótopos .
EVOLUÇÃO EM AÇÃO: CARBON DATING

Figura 4. A idade dos restos que contêm carbono e têm menos de 50.000 anos de idade, como este mamute pigmeu, pode ser determinada usando datação por carbono.
Carbono-14 ( 14 C) é um radioisótopo natural que é criado na atmosfera por raios cósmicos. Este é um processo contínuo, então mais 14 C está sempre sendo criado. À medida que um organismo vivo se desenvolve, o nível relativo de 14 C em seu corpo é igual à concentração de 14 C na atmosfera. Quando um organismo morre, ele não está mais ingerindo 14C, então a proporção diminuirá. 14 C decai para 14 N por um processo chamado decaimento beta; Ele libera energia nesse processo lento.
Após aproximadamente 5.730 anos, apenas metade da concentração inicial de 14 C terá sido convertida em 14 N. O tempo que leva para que metade da concentração original de um isótopo decaia para sua forma mais estável é chamado de meia-vida. . Como a meia-vida de 14 C é longa, é usada para envelhecer objetos anteriormente vivos, como os fósseis. Usando a razão entre a concentração de 14 C encontrada em um objeto e a quantidade de 14C detectado na atmosfera, a quantidade do isótopo que ainda não decaiu pode ser determinada. Com base nessa quantidade, a idade do fóssil pode ser calculada em cerca de 50.000 anos (Figura 4). Isótopos com meia-vida mais longa, como o potássio-40, são usados para calcular as idades dos fósseis mais antigos. Através do uso de datação por carbono, os cientistas podem reconstruir a ecologia e a biogeografia de organismos que vivem nos últimos 50.000 anos.